¿Qué es un enlace iónico o electrovalente? Es el resultado de la unión de iones que tienen cargas totalmente opuestas, es decir, uno electropositivo y el otro electronegativo. Este tipo de enlace surge entre los elementos metálicos y no metálicos y, para que la unión se pueda dar, es obligatorio que uno de los dos tenga más electronegatividad, concretamente un 1,7.
Algunas de las características más destacadas es que en vez de crear moléculas aisladas surgen redes cristalinas con una estabilidad muy alta, entonces para separar los iones se necesita mucha energía.
A continuación te mostramos cantidad de ejemplos de enlaces iónicos para tener una información más completa acerca de este concepto químico.
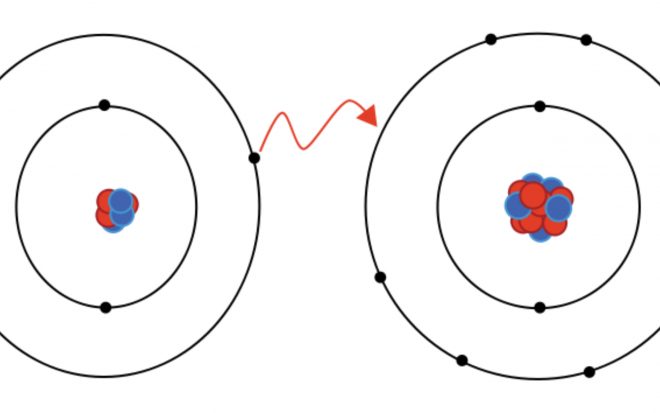
Ejemplos de enlaces iónicos
| Sulfato de cobre | Fosfato disódico | Fluoruro de litio |
| Sulfato de potasio | Ioduro de potasio | Nitrato de plata |
| Hidróxido de zinc | Cloruro de sodio | Óxido de zinc |
| Nitrato de calcio | Dicromato de potasio | Sulfuro de hierro |
| Cloruro de potasio | Ácido sulfúrico | Cloruro de manganeso |
| Nitrato de calcio | Hidróxido de potasio | Bromuro de potasio |
| Óxido de berilio | Carbonato de calcio | Sulfato de potasio |
| Cloruro de cobre | Cloruro de magnesio | Hipoclorito de sodio |
| Cloruro de Plata | Óxido de hierro | Fosfato de calcio |
Ejemplos de enlaces iónicos con sus respectivos usos
- Ácido fluorhídrico: es una sal catódica que se utiliza para la elaboración de dentríficos para una correcta higiene bucal, además de ser necesario para otros productos odontológicos.
- Hidróxido de potasio: es un compuesto químico inorgánico que cumple la función de ser empleado para el ámbito industrial y comercial por su capacidad de provocar reacciones químicas con ácidos.
- Ácido nítrico: se hace uso de ello para la elaboración de pólvora, y en ciertas ocasiones, para los fertilizantes.
- Cloruro de sodio: es la sal que se encarga de la salinidad del océano, además de ser un fluido extracelular de ciertos organismos. También se utiliza como condimento de los alimentos.
- Ácido permangánico: es una sal que tiene un color como violeta y su mayor poder es ser oxidante, entonces hace que se pueda aprovechar para la síntesis de la sacarina o para la elaboración de ciertos antisépticos.
- Óxido de magnesio: la principal aplicación es servir como material refrectario al ser muy estable a temperaturas elevadas. También sirve para fabricar cemento y como fertilizante en la agricultura.
- Hipoclórito de sodio: es el componente principal para elaborar el blanqueador doméstico. Se conoce más bien como lejía y sirve para limpiar y desinfectar el hogar.
- Dicromato de potasio: es un compuesto que se utiliza para elaborar productos de limpieza fuertes, ceras, pinturas, colas y demás. También es necesario en las exhibiciones de pirotecnia.
- Ácido sulfúrico: La unión del metal y no metal hace que se originen aditivos en la obtención de material para la edificación, además de insumo para los rayos X de contraste.
- Nitrato de calcio: es una sal anhidra incolora que se emplea para distintas cosas: fertilizantes, tratamiento de aguas residuales y elaboración de hormigón.
